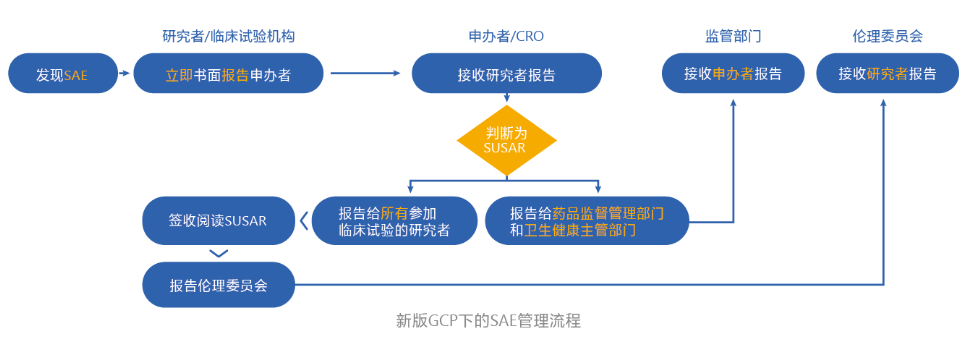
新版GCP下,安全性信息管理流程变化显著:申办者是临床阶段SAE/SUSAR的主体负责人;伦理委员会需以全景视角、全程追踪并审查安全性报告;临床研究机构作为受试者保护的责任主体,需及时关注来自申办者的SUSAR报告。
根据这些变化,太美医疗科技及时作出反应,推出了全面满足新版GCP要求的“SAE管家”安全性信息沟通管理系统,帮助申办者、研究者/研究机构、伦理委员会、CRO等各参与方实现对安全性信息高效、便捷的沟通和管理。
新版GCP下的SAE管理流程
SAE management process under the new GCP
SAE管家——高效管理临床试验安全性信息
Ultra efficiency in safety data management in clinical trials
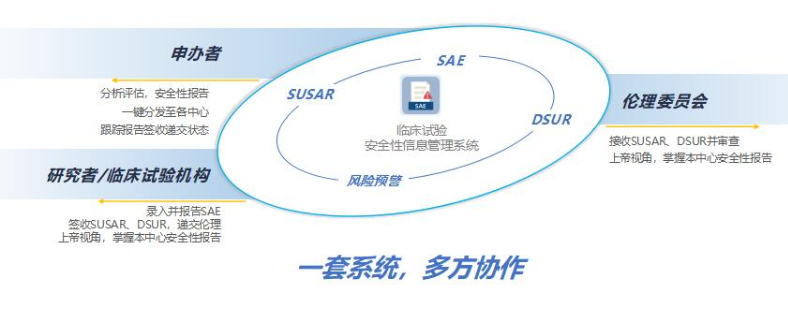
SAE管家的系统特点System Features
全流程 信息化管理
全面满足新版GCP要求
SUSAR跨项目、跨项目一键分发
分发、上报、回执记录、结果统计
多方互通协作
形成临床药物警戒管理闭环
以申办者为核心,打通研究者、机构、
伦理端,实现安全性数据协作、互通
高质量临床安全性数据
前道录入至后道分析,打通完整数据链条
E2B模板、录入辅助、研究者培训,
保证数据质量及完整性
节约申办者报告处理成本呢,聚焦分析
高效保障受试者权益
助力机构、伦理提升安全性报告处理质效
开启“上帝视角”,
安全性报告全流程状态尽在掌握







175万,广州医科大学附属第一医院采购医疗设备招标项目采购结果公告
99万,中山大学附属第一医院医保综合管理系统二期项目公开招标
239万,北大荒集团牡丹江医院信息系统升级改造服务中标结果公告
65万,福鼎市中医院DIP临床路径信息系统竞争性磋商公告
1599万,广州中医药大学第一附属医院重庆医院(重庆市北碚区中医院)智慧医院一体化信息系统及医院HIS系统软硬件建设中标公告
166万,昌宁县医共体审方中心系统(二次)中标结果公告